
编者按
原发性肝癌(Primary Liver Cancer, PLC)是全球癌症相关死亡的第三大原因,包括肝细胞癌(Hepatocellular Carcinoma, HCC)、肝内胆管癌(Intrahepatic Cholangiocarcinoma, ICC)及混合型肝细胞-胆管癌(Combined Hepatocellular-Cholangiocarcinoma, CHC)。肿瘤内异质性(Intra-tumor Heterogeneity, ITH)被认为是癌症治疗的主要障碍。先前的研究已经揭示了HCC、ICC和CHC中存在相当程度的基因组异质性,反映了具有不同分子特征的多样化细胞群,决定了药物敏感性并可能导致治疗失败。
患者来源的类器官(Patient-derived Organoids, PDO)培养已被证明是一种强大的工具,可以用于再现肿瘤异质性并研究不同癌症类型中的药物敏感性,包括PLC疾病建模和药物筛选。然而,以前的PLC类器官研究受到样本数量的限制,且缺乏多区域样本。因此,建立一个大规模的PLC类器官生物库,对PLC异质性的深入理解和开发新的治疗策略,尤其对个性化医疗和精准治疗至关重要。
今天,我们分享2024年4月8日由北京大学第一医院张宁教授团队联合北京大学肿瘤医院吴健民教授团队、河南省肿瘤医院张建功团队、北京大学第一医院杨兴团队等发表在《Cancer Cell》(IF=50.3)的最新研究——Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer,该研究建立了一个来自144例肝癌患者的、399个肝癌类器官生物库,能重现原发性肝癌(PLC)的组织病理学和基因组特征,发现ITH与肝癌患者生存率差和耐药机制之间的关系;并通过大规模靶向药的药敏筛选对靶向药药敏进行了分子分型,揭示了c-Jun介导的lenvatinib耐药机制,发现lenvatinib与c-Jun抑制剂(Veratramine)具有协同抗肿瘤作用,开发了预测药物反应的生物标志物,确定了仑伐替尼耐药的机制,为肝癌的精准诊疗提供了重要指导。
文章题目
Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer
杂志:《Cancer Cell》(IF=50.3)
发表时间:2024年4月8日
作者:张宁、吴健民、杨兴、张建功等
单位:北京大学第一医院、北京大学肿瘤医院、河南省肿瘤医院等
01、研究结果
1. 多区域肝癌类器官生物库揭示肝癌的组织学、基因组学和转录组学特征
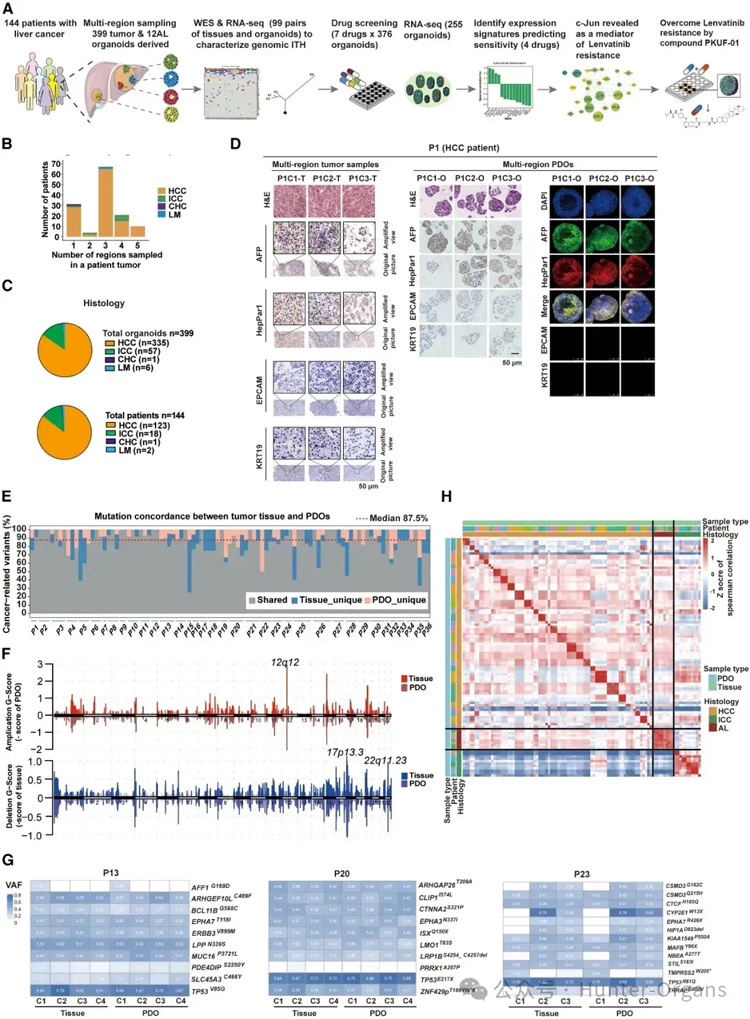
图1
研究团队对肝癌患者的手术标本进行多点取样,成功建立了来自144位患者的399个肿瘤类器官生物库(图1A)。
基于HE染色,从每个组织样本中收集1-5个区域进行研究,观察证实了类器官与亲代组织间的组织病理学相似。在HCC患者中,多区域来源的类器官和亲本肿瘤组织都显示HCC标记物(HepPar1/AFP)和ICC标记物(KRT19/EPCAM);患者来源的类器官异种移植物(PDOX)模型也重现了亲代肿瘤的组织病理学。通过免疫荧光、免疫组化,证实了类器官与组织的表型异质性。
接着,研究团队通过全外显子组测序(WES)、RNA测序(RNA-seq),从体细胞突变(somatic mutations)、拷贝数变异(copy number alterations, CNA)和转录组相似性等多维度,评估类器官生物库重现PLC组织肿瘤间和肿瘤内的异质性。
结果显示,肿瘤组织和类器官之间的突变负荷相当,包括TP53,AXIN1和CTNNB1;在肿瘤组织和类器官之间发现87.5%的癌症相关突变的中位一致性。这表明,类器官的组织病理学特征与亲本肿瘤相似,而且能表达肝细胞癌和肝内胆管癌的标志物(图 1C、D);通过分析类器官的基因表达谱发现,类器官与亲本肿瘤之间存在高度的相关性(图 1H)。
总之,研究表明,PLC衍生的PDOs保留了亲代组织的病理学特征、基因组和转录组学特征,有助于探究PLC肿瘤间和肿瘤的异质性(图1)。
2. 肝癌基因组肿瘤内异质性(ITH)多区域类器官特征分析
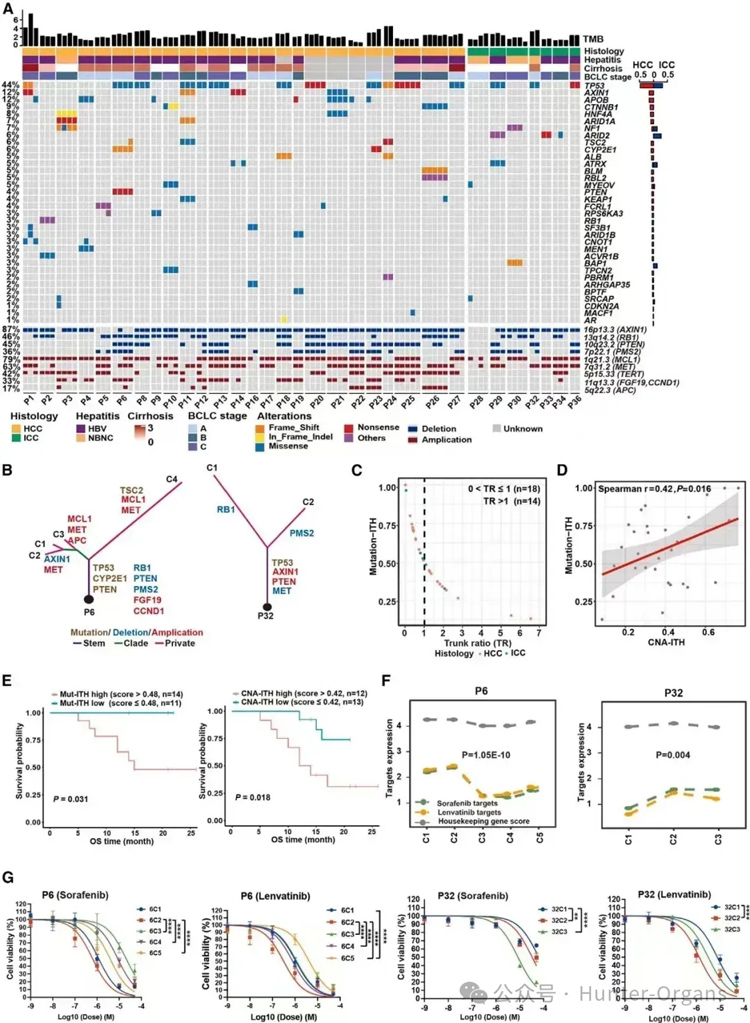
图2
研究人员对32名肝癌患者的多区域类器官进行了基因组分析,发现显著的基因组异质性。研究人员发现,包括P1、P4、P6和P23在内的一个亚组患者在多区域样本中肿瘤突变负荷(TMB)存在明显差异;不同区域的肿瘤样本在基因突变和拷贝数变化方面存在差异(图 2A);一些与肝癌相关的基因在不同区域的表达存在差异(图 2F)。
为了验证基因组和相关转录组的异质性是否可能导致药物敏感性的异质性,研究人员用79例患者的、255例PDOs研究了PLC一线药物索拉非尼(sorafenib)和乐伐替尼(lenvatinib)靶基因的表达,结果显示,一些患者(如P6和P32),在来自不同区域类器官中的靶基因表达存在很大差异,这表明可能存在肿瘤内药物反应的异质性。
为了证实这一点,研究人员用这两种药物处理P6和P32患者的多个类器官培养物,发现靶基因表达水平降低的区域显示出更高的耐药性(图2)。总之,研究人员揭示了PLC中存在与预后相关的、广泛水平的基因组ITH,并可能导致对药物治疗的异质反应。
3. 筛选临床相关药物预测患者反应,揭示肿瘤内药物敏感性的异质性
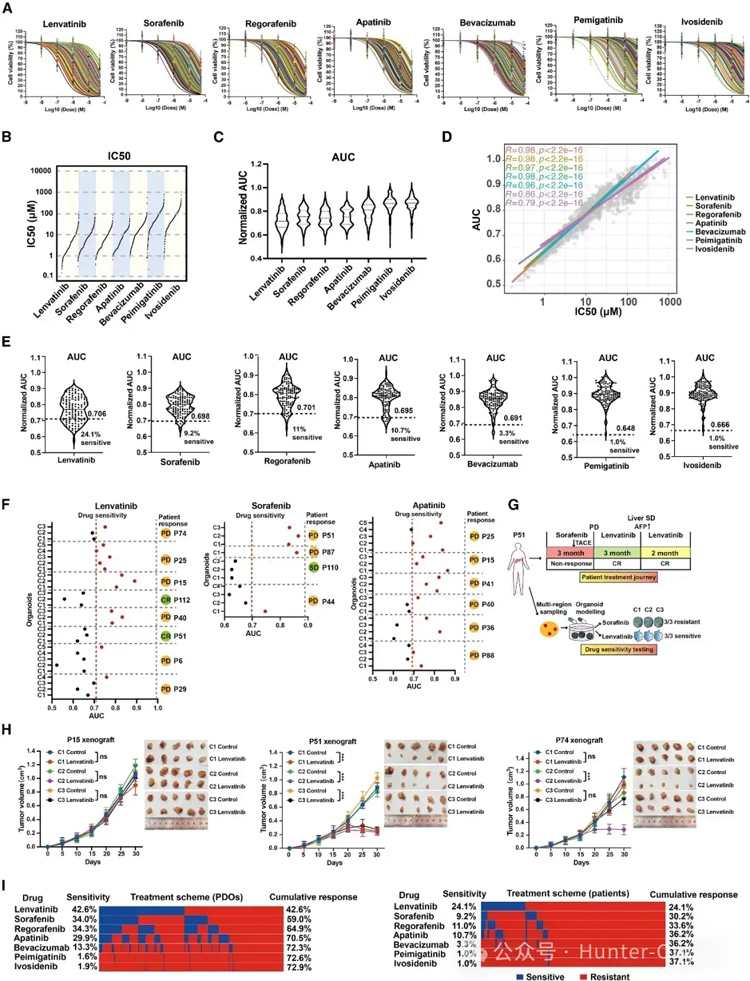
图3
研究人员在116名患者的376种类器官中筛选出7种PLC相关药物,包括一线药物乐伐替尼(lenvatinib)和索拉非尼(sorafenib),二线药物瑞格拉非尼(reorafenib)和阿帕替尼(apatinib),anti-VEGFR抗体贝伐单抗(bevacizumab),以及靶向具有可操作突变的ICC药物,包括佩米替尼(pemigatinib,靶向含FGFR2融合/重排的胆管癌)和艾伏尼布 (ivosidenib,靶向IDH1突变的化疗难治性胆管癌)。结果显示,7种筛选药物的IC50和AUC值之间存在很强的相关性。
接着,研究人员基于类器官药物敏感性结果与相应临床反应进行比较,发现临床反应支持使用类器官的乐伐替尼(lenvatinib)敏感性结果,与索拉非尼(sorafenib)、阿帕替尼(apatinib)的类似比较,也证实了类器官药物筛选的预测价值。
此外,类器官药物筛选的结果也通过类器官来源的PDOX模型得到验证,患者来源的类器官被移植到免疫缺陷小鼠体内,其对乐伐替尼(lenvatinib)的治疗均有抑制作用。
最后,研究人员利用药物筛选结果定量评估了目前临床上用于PLC患者的七种靶向治疗药物的潜在益处。尽管不同地区的所有衍生类器官的累计敏感性可达到72.9%,但不同区域间来源的类器官药物敏感性水平和患者敏感性水平之间存在显著差异(图3)。
这些结果表明,PLC类器官可以用于预测患者对药物的反应,为个性化治疗提供指导。
4. 分子生物学分析确定预测临床相关药物敏感性的表达特征
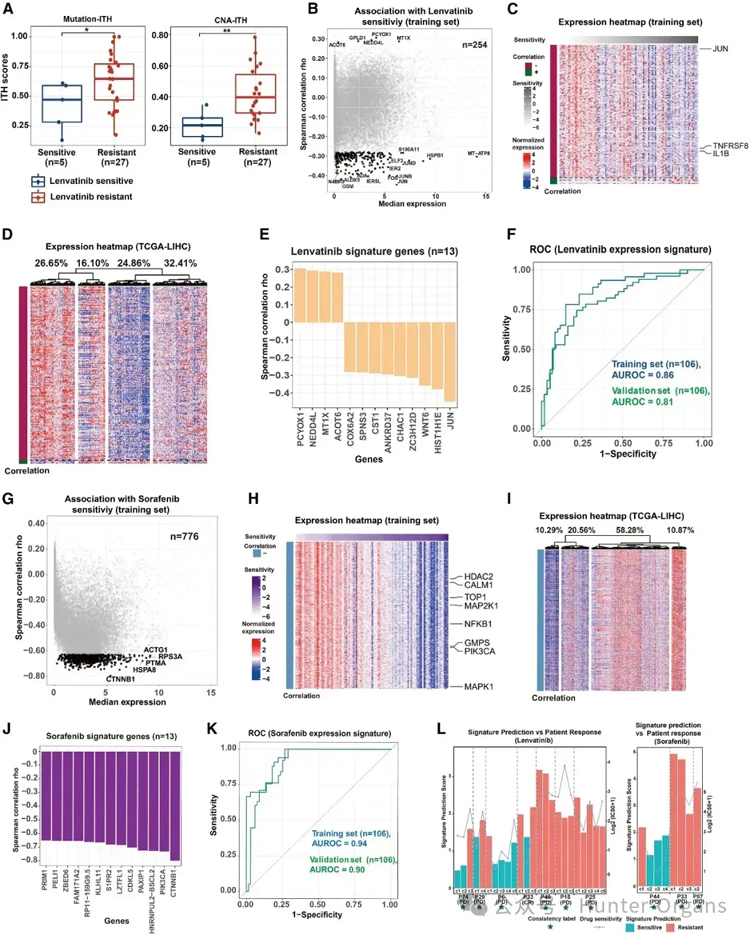
图4
基因组异质性已被认为是耐药的主要因素,研究人员首先探究多区域PDOs基因组异质性与PLC药物敏感性的关系。与敏感组相比,乐伐替尼耐药组患者突变ITH明显偏高,这表明ITH在乐伐替尼治疗耐药中的作用。通过研究基因组ITH与索拉非尼(sorafenib)、瑞格拉非尼(reorafenib)和阿帕替尼(apatinib)敏感性的关系,发现阿帕替尼耐药组患者的CAN-ITH水平升高。
接着,为了确定生物标志物开发中与药物反应相关的关键基因,研究人员通过机器学习模型解析了肝癌临床靶向药的药敏分子分型,揭示了13个lenvatinib药敏标记物,包括JUN、HIST1H1E和WNT6A。
此外,研究人员开发了sorafenib、regorafenib和apatinib治疗反应的预测性生物标志物,并通过PLC药物治疗的患者和多区域类器官分析来评估生物标志物的临床作用。其中,7例乐伐替尼治疗患者中有6例在特征预测和临床反应之间展现高度一致的结果,而索拉非尼和阿帕替尼治疗患者的结果完全一致(图4)。
总之,研究人员开发并验证了对特定药物反应的多基因表达特征,有助于精确医疗的实施(图4)。
5. c-Jun介导的乐伐替尼耐药性
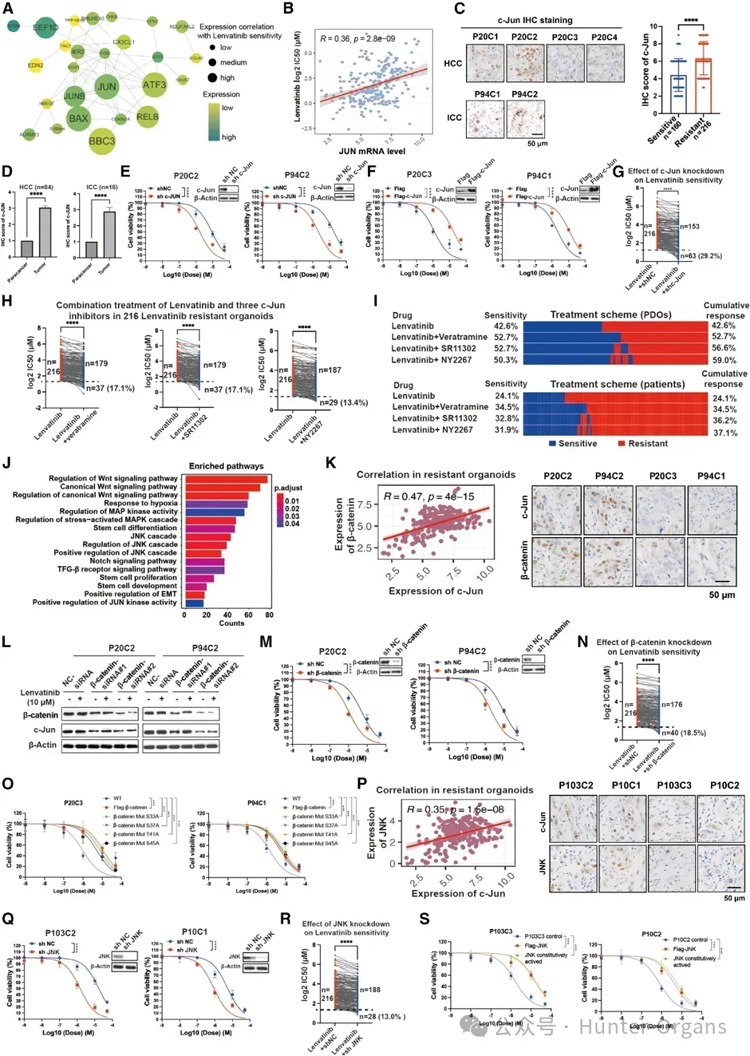
图5
为了鉴定肝癌一线药物lenvatinib的耐药基因,研究人员使用与lenvatinib敏感性显著相关的基因进行蛋白-蛋白相互作用(PPI)网络分析。其中,JUN是该PPI网络的枢纽蛋白,是lenvatinib反应的13个特征基因之一,也是FDA批准的药物靶标。研究发现,JUN基因表达与lenvatinib治疗不敏感性显著正相关。免疫组化(IHC)分析c-Jun蛋白水平,216个lenvatinib耐药类器官的C-Jun表达显著高于160个敏感类器官。
此外,100例患者肿瘤中的c-Jun表达高于其配对的癌旁组织;进一步研究HCC患者(P20)和ICC患者(P94)对lenvatinib治疗的反应,结果显示与敏感类器官相比,lenvatinib耐药类器官中c-Jun的水平升高,c-Jun敲低可致敏lenvatinib耐药类器官,c-Jun过表达则敏感性有所减少。
为了揭示c-Jun介导的lenvatinib耐药的信号通路,研究人员通过对245个与lenvatinib应答显著负相关的基因进行功能富集分析发现,Wnt和c-JNK信号通路显著失调。在lenvatinib耐药类器官中,β-catenin(一种关键的Wnt信号调节因子)和c-Jun的表达呈正相关。使用P20(HCC)和P94(ICC)类器官进行功能研究,发现在lenvatinib耐药类器官中均显示高水平的c-Jun和β-catenin,而在敏感类器官中则显示低水平;18.5%的类器官对β-catenin敲低敏感。此外,野生型和突变型β-catenin的过度表达显著降低了这两种敏感类器官对lenvatinib治疗的敏感性;在lenvatinib耐药区域,JNK和c-Jun的表达也呈正相关。
这些结果表明,JNK和Wnt/β-catenin可能是c-Jun介导lenvatinib耐药的上游调控因子(图5)。
6. c-Jun抑制剂与lenvatinib具有协同抗肿瘤作用
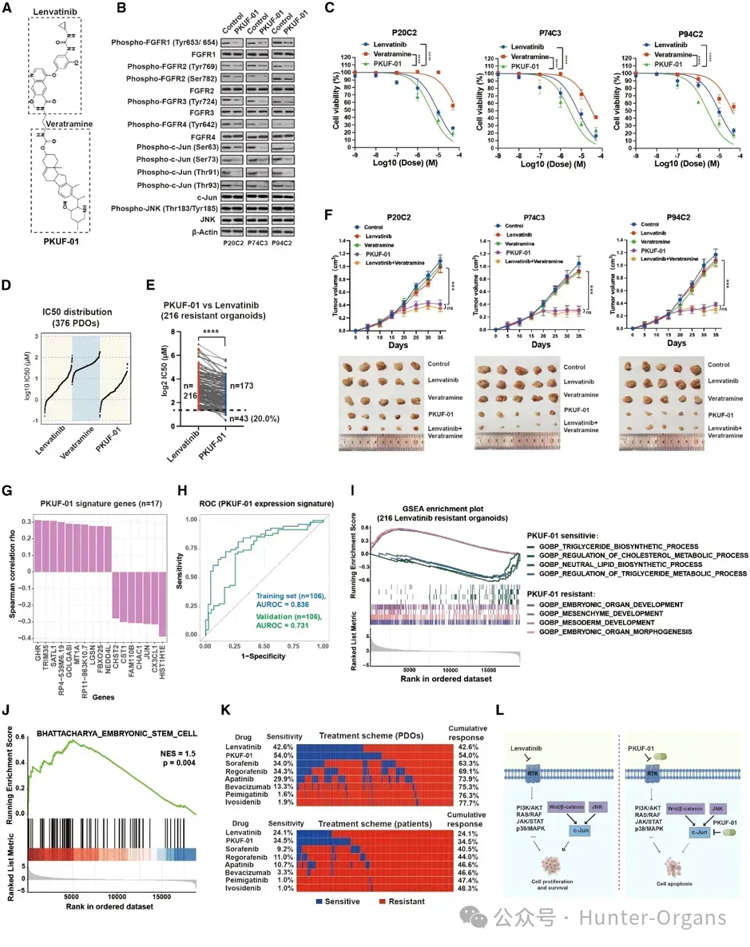
图6
基于研究团队发现的lenvatinib和c-Jun抑制剂的协同用药效果,研究人员设计合成了6种连接lenvatinib和c-Jun抑制剂Veratramine的化合物,合成PKUF-01,并通过体内外实验证明了其优于lenvatinib的肿瘤杀伤效果。
当PKUF-01与类器官生物库进一步评估时,发现与lenvatinib治疗相比,敏感性显著提高。通过进一步验证PKUF-01在类器官PDOX模型中的疗效发现,lenvatinib或veratramine治疗未能抑制PDOXs,而PKUF-01治疗可显著抑制肿瘤生长。
总之,lenvatinib可以靶向FGFR和其他受体,减弱下游信号以抑制肿瘤生长;然而,受Wnt/β-catenin和JNK途径调控的c-Jun有助于lenvatinib耐药。PKUF-01靶向c-Jun在lenvatinib耐药类器官中显示出显著疗效,并可能使更多PLC患者受益(图6)。
02、编者点评
总而言之,研究团队建立了一个来自144例患者的、399个肝癌类器官生物库,能重现原发性肝癌的组织病理学和基因组特征,并研究其对多种药物的敏感性,为患者提供更精准的治疗选择。
研究中对c-Jun作为Lenvatinib耐药性的介质的发现,为克服临床治疗中的耐药问题提供了新的靶点。通过合成化合物PKUF-01及其与Lenvatinib的协同效应,开发的预测性生物标志物和联合治疗方案值得未来的临床研究,以促进肝癌的精准医疗。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型及人诱导多能干细胞及多种癌种的类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] Yang H, Cheng J, Zhuang H, Xu H, Wang Y, Zhang T, Yang Y, Qian H, Lu Y, Han F et al: Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer. Cancer cell 2024, 42(4):535-551. doi: 10.1016/j.ccell.2024.03.004.
