
编者按
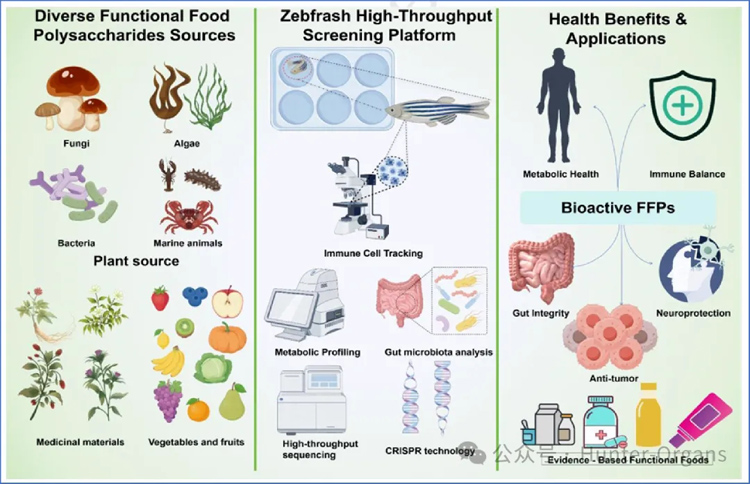
当前,功能性食品多糖 (FFPs)备受关注,展现出免疫调节、代谢稳态调节、肠道菌群优化、抗氧化保护等诸多优势,正成为现代营养和食品科学中的关键成分。数据显示,预计2030年全球功能性食品市场将达到2750亿美元,亟需对功能性食品多糖 (FFPs)开展更深入地研究与功效验证,以满足消费者对循证健康产品日益增长的需求。然而,传统的细胞模型对体内功效性预测较差,哺乳动物模型又受到成本高、实验周期长、伦理限制等局限。斑马鱼模型,作为一种强大的高通量筛选平台,有效弥合了体外细胞模型和哺乳动物模型之间的鸿沟,为经济高效的功能性食品多糖筛选提供了可能。
2026年1月12日,南开大学药学院药物化学生物学国家重点实验室和天津市分子药物研究重点实验室研究团队在Carbohydr Polym(IF=12.5)上发表了最新研究成果,该综述系统阐述了斑马鱼模型在功能性食品多糖研究中的应用价值与发展前景,并汇总了该模型在免疫调节、代谢稳态、肠道健康、神经保护与抗肿瘤活性等关键领域中的应用,提出整合斑马鱼、细胞与哺乳动物研究的五层验证体系,以应对转化挑战并降低临床开发风险。
目前,环特生物已开发了斑马鱼免疫调节、代谢稳态、肠道健康、神经保护与抗肿瘤活性等280多种斑马鱼模型,部分模型如下,欢迎新老客户咨询!
01、研究亮点
斑马鱼弥合了细胞模型和哺乳动物模型之间的鸿沟,为经济高效的功能性食品多糖筛选提供了可能;
利用斑马鱼优势,实现多糖生物活性的实时、动态观测,并强调多糖分子量、硫酸化修饰与单糖组成等结构特征对其生物活性的预测价值;
构建了“斑马鱼筛选与验证、细胞、哺乳动物、临床实验”等五层递进验证体系,提升应用转化效率与可靠性;
指出人工智能、多组学分析与基因编辑等前沿技术,将推动多糖研究进入精准设计与机制深挖的新阶段。
论文摘要
02、主要应用
1. 斑马鱼在功能性食品多糖(FFPs)研究中的优势
当前,斑马鱼模型已成为一种革命性的高通量筛选平台,弥合了体外细胞模型和哺乳动物模型之间的鸿沟。其与人类基因相似度高达80%以上,能可靠模拟关键的人类生理过程,如器官发育、免疫功能和新陈代谢。至关重要的是,其独特优势使高通量筛选(HTS)成为可能——光学透明性,可实时可视化观测斑马鱼内部结构和动态过程;发育快速,主要器官在受精后24-120小时内功能成熟;高产卵量,一次交配可产生数百枚胚胎,适合大规模筛选;易于培养,可进行96/384孔板培养,自动化程度高;低成本,每枚胚胎成本仅需10-50美分,远低于哺乳动物。这种兼具细胞筛选高通量特色、哺乳动物模型的完整生理背景,使斑马鱼成为优秀的体内实验模型。
为了探究斑马鱼在FFPs研究中的潜力,研究人员对斑马鱼与三种替代方法——传统的细胞检测、哺乳动物及新兴的类器官共培养模型进行了系统比较——

表1. 用于FFPs筛选的实验模型对比
如表1所示,斑马鱼在转化应用研究中具有独特的优势,且起到了连接体外与体内研究的桥梁作用。其核心优势在于能够在完整的生理背景下,对多糖生物活性进行高通量初步筛选,且保持接近细胞检测的速度和成本效益,因此,斑马鱼是最优的“首筛”体内过滤器,可以优先筛选出候选物,随后在细胞和哺乳动物模型中进行验证,从而提升药物发现效率。斑马鱼模型在由先天免疫主导的生理病理性疾病研究中优势显著,如抗感染反应、急性炎症、代谢失调、肠道屏障等,也具备实时可视化、基因操作和多组学整合能力,使其也成为了解析复杂构效关系的理想模型。
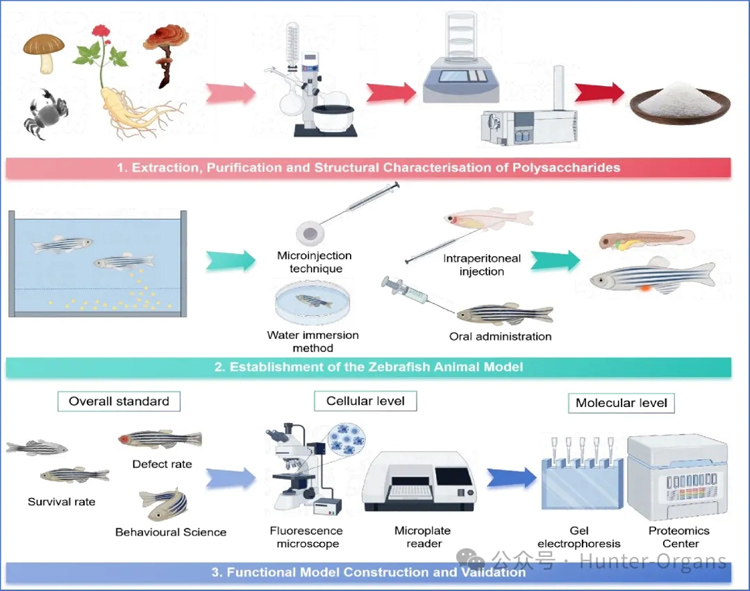
图1
2. 斑马鱼加速功能性食品多糖核心功效的发现
斑马鱼模型凭借其独特优势,已在功能性食品多糖(FFPs)的多种生物活性研究方面展现出显著的应用潜力,如表2——

表2. 利用斑马鱼筛选的代表性FFPs(2017-2025)
2.1 免疫调节:先天免疫的实时可视化
斑马鱼拥有与哺乳动物高度相似的先天免疫系统,使其成为研究多糖免疫调节功能的理想模型。通过实时、动态观察斑马鱼胚胎,可以用来研究多糖调节先天免疫应答过程)。在机械损伤、细菌感染或化学刺激诱导的斑马鱼炎症模型中,可以直接观察中性粒细胞和巨噬细胞等免疫细胞的初始招募、浸润及炎症部位,以及后续吞噬、清除病原体的过程,为评估多糖免疫增强或免疫抑制作用提供了高通量、直观且与生理过程密切相关的平台。
如,Pérez-Ramos等人利用斑马鱼探究了β-葡聚糖 (微球菌)的免疫调节特性,发现多糖通过抑制促炎细胞因子,减少炎症部位细胞积累,从而发挥抗炎作用(Pérez-Ramos等,2018);褐藻多糖通过抑制炎性细胞因子(TNF-α、IL-1β)的表达、减少ROS产生和调节NF-κB信号通路,有效缓解斑马鱼中脂多糖(LPS)诱导的炎症反应(Wang等,2022);灵芝多糖和藻类多糖在斑马鱼中也显示出增强巨噬细胞活化和吞噬功能、提高对细菌病原体的清除效率及增强抗病毒免疫中干扰素表达的潜力(Cai等,2017);Yue等人从嗜热链球菌XJ53中分离出胞外多糖(EPS53),斑马鱼实验表明,EPS53通过抑制促炎细胞因子的表达,上调抗炎细胞因子的表达,显著调节斑马鱼免疫反应,从而显示出强大的免疫调节作用(Yue等,2024)。
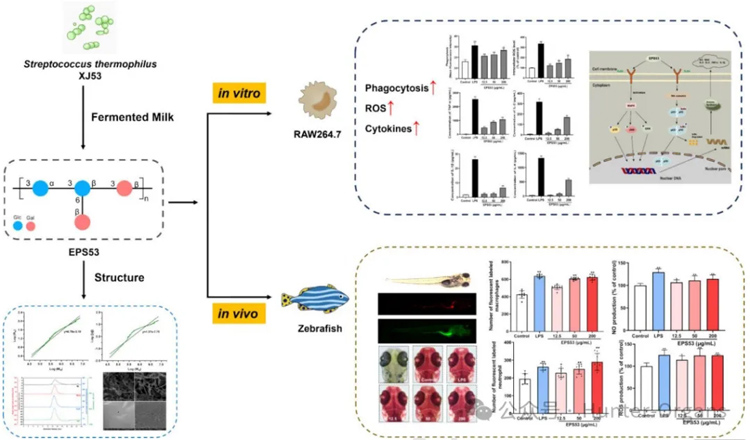
图2
2.2 代谢调节:高通量疾病建模
斑马鱼与人类在糖脂代谢、胰岛素信号通路、内分泌调节等方面高度相似,使其成为研究多糖代谢调节作用的绝佳模型。通过快速诱导斑马鱼代谢紊乱表型,如肥胖、高脂血症、胰岛素抵抗和脂肪肝等,建立稳定且易于筛选的斑马鱼代谢综合征模型,可以高通量评价多糖改善糖脂代谢功效。
Lan等人发现,沙棘多糖(SP)显著降低了高脂饮食(HFD)诱导的斑马鱼脂质积累,SP改善了肝脏和肠道健康,提高了斑马鱼存活率(Lan等,2022);Suo等人在2型糖尿病(T2DM)斑马鱼模型中,发现了杏多糖 (DAP-2)的降血糖作用机制,DAP-2可以有效调节肠道菌群结构,改善肠道微环境(Suo et al., 2025);在高脂饮食诱导的斑马鱼模型中,羊栖菜多糖 (SFPS)及其超声降解羊栖菜多糖(SFPSUD)表现出显著的降血脂效果, SFPSUD效果更佳(Wu等, 2024);斑马鱼实验表明,当归多糖(ASP)通过调节肠道菌群组成、增加有益菌的相对丰度,来改善脂质代谢。ASP作为一种潜在的益生元,可能通过调节肠道菌群,来预防脂质代谢紊乱(Chen等,2025)。
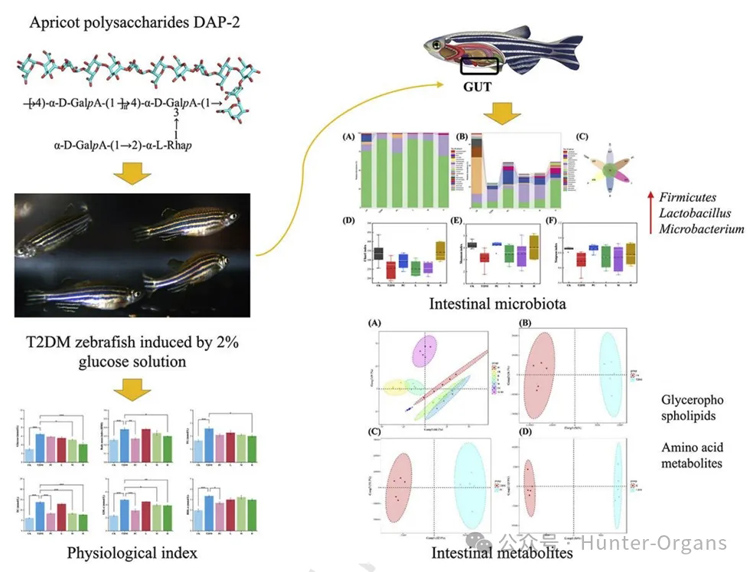
图3
2.3 肠道健康:微生物群-宿主相互作用研究
斑马鱼的肠道结构相对简单,但其肠道菌群组成、屏障功能及与宿主的相互作用模式与哺乳动物高度相似。通过给药或与益生菌/病原体共培养,可以研究多糖对肠道形态发育、肠道屏障完整性、炎症反应及肠道菌群结构、功能的影响,以及初步探索对“肠-脑-免疫”轴的潜在调节作用。
例如,研究表明,多糖对斑马鱼肠道炎症具有缓解作用。研究发现,乳酸菌发酵的多糖类物质能通过调节肠道菌群、减轻氧化应激及调控NF-κB/MAPK等信号通路来缓解肠道炎症,为开发治疗肠道炎症的功能性产品提供了理论依据(Su等,2025;Zhang等,2025);斑马鱼实验也发现,多糖可以作为益生元,促进乳酸杆菌、双歧杆菌生长,产生短链脂肪酸(SCFAs),维持肠道微生态平衡并增强肠道屏障功能(Suo等,2025);Li等人从板蓝根中分离的酸性多糖IRPS-TE-3,通过激活TLR4/MAPK通路,显著缓解了氯霉素诱导的斑马鱼肠道炎症,减少免疫细胞凋亡,降低炎症因子,恢复屏障功能(Li等,2025);Wang等人利用斑马鱼结肠炎模型发现,从骆驼刺蜜中分离出的新型果胶样多糖AH-H4-1,可以有效减少中性粒细胞浸润,恢复杯状细胞分泌和屏障完整性,首次证实了植物多糖可以通过调节先天免疫,来缓解肠道炎症,为开发针对结肠炎的功能性食品提供了新的理论依据(Wangetal.,2025)。
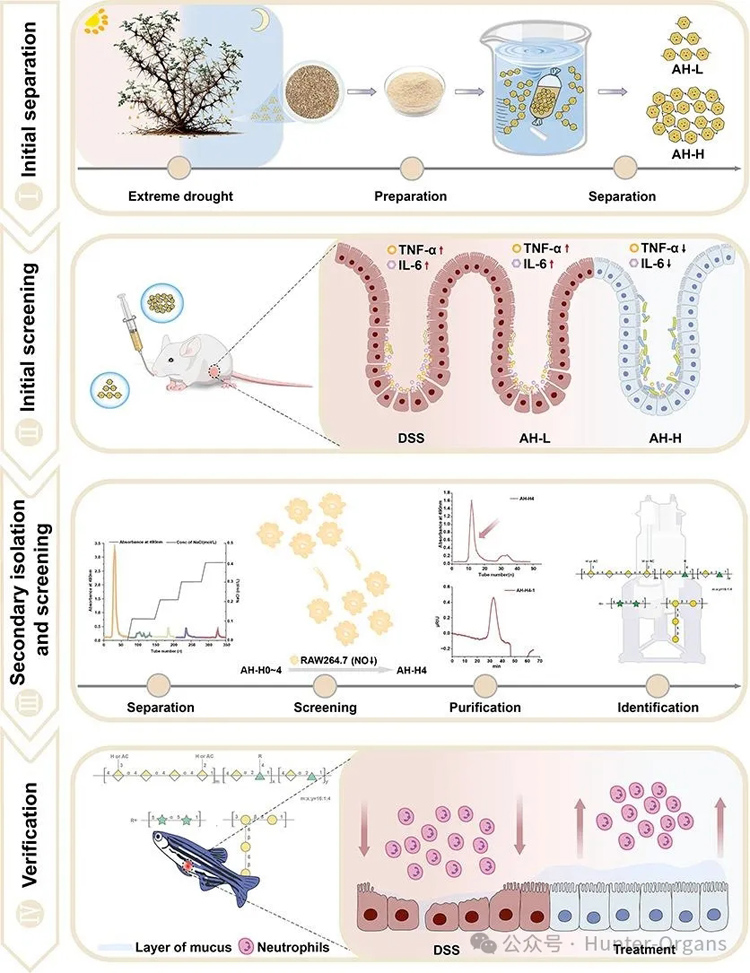
图4
2.4 神经保护:氧化应激与行为表型分析
斑马鱼模型对环境毒素敏感,通过快速建立氧化应激、神经炎症或神经退行性疾病模型,可以直接观察多糖对活性氧(ROS)清除、神经元存活、胶质细胞激活及其行为指标(如运动能力、感觉知觉)的影响。
例如,在斑马鱼氧化应激模型中,Wang等人发现,羊栖菜高硫酸化多糖HFPS能降低ROS生成并减少细胞死亡,提高存活率,具有显著的抗氧化潜力(Wang等, 2018);在斑马鱼帕金森病模型中,Farias等人评估了黄柏硫酸化多糖(SPs)对帕金森病(PD)的潜在治疗作用,发现SPs处理的斑马鱼视动反应(OMR)正常,表明其对中枢神经系统并无显著不良影响,展现出良好的生物相容性和安全性,不会引起胚胎毒性、神经毒性(Farias等,2025);Yan等人利用斑马鱼发现,决明子低分子量半乳甘露聚糖(LMW-GM)显著提高了斑马鱼的存活率和SOD活性,表现出显著的抗氧化特性和神经保护作用,有望开发为新型神经保护剂和抗氧化剂(Yan等,2023)。
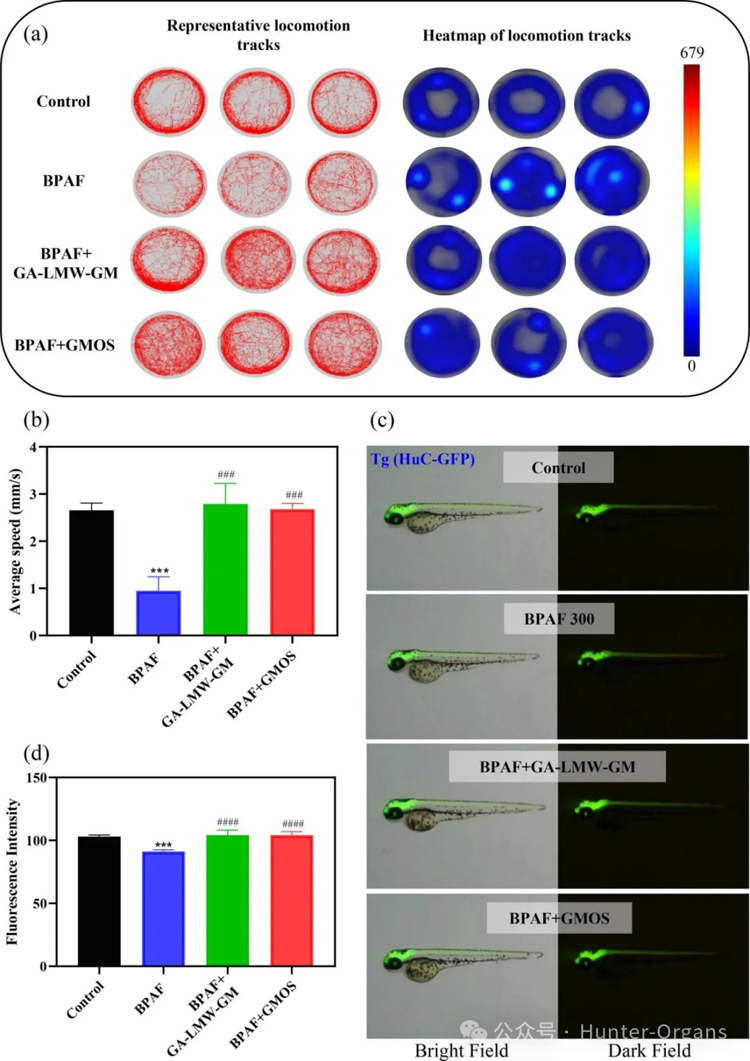
图5
2.5 斑马鱼异种移植模型揭示抗肿瘤活性
斑马鱼因其胚胎透明、免疫缺陷幼鱼及与人类相似的后天性免疫系统而常被用于肿瘤建模。常见的斑马鱼肿瘤模型包括三种类型:诱导型、转基因型和移植型。在斑马鱼诱导模型中,肝癌模型最常见,常使用NDMA和DBP作为诱导剂;转基因模型,常采用基因编辑技术敲除特定遗传性肿瘤抑制基因,建立高侵袭性黑色素瘤模型;肿瘤移植模型通常通过将标记的肿瘤细胞注射到胚胎中,但也有成鱼腹腔注射实例。
Cai等人证实,在B16F10黑色素瘤细胞和斑马鱼模型中,从羊肚菌中提取的多糖FMP-1通过抑制CREB/p38MAPK通路,降低了酪氨酸酶(TYR)活性和黑色素含量,展现出显著的抗黑色素生成作用(蔡等,2018);Feng等人发现,源自红藻龙须菜的新型杂多糖GLHP,能够阻断α-黑色素细胞刺激素(a-MSH)/黑皮质素-1受体(MC1R)信号通路,显著抑制斑马鱼黑色素生成(冯等,2023)。Chen等人从红景天根茎中分离纯化了一种阿拉伯糖多糖(HJBP85-1),研究结果显示,HJBP85-1在斑马鱼异种移植模型中,通过抑制肿瘤细胞迁移和血管生成,并通过促进巨噬细胞M1极化和诱导树突状细胞成熟与激活,来调节免疫反应,从而显著抑制肿瘤进展(Chen等,2025)。He等人研究了从东方栓菌中分离的水溶性多糖(TOP-2),在斑马鱼异种移植模型中,TOP-2显著抑制了肝癌细胞扩散和增殖。其抗肿瘤作用是通过抑制肿瘤细胞迁移和血管生成实现的,也通过调节免疫反应发挥作用(He等,2025)。鉴于斑马鱼成本低、可视化、免疫缺陷等独特优势,其在肿瘤研究中的重要性日益凸显。
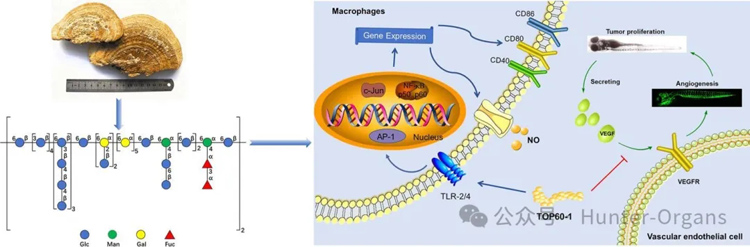
图6
2.6 多糖的心血管保护及其他功效研究
除了上述核心应用外,斑马鱼模型在其他新兴领域也展现出巨大的应用潜力。研究人员正利用斑马鱼探究多糖对心血管的保护作用,如血栓形成、血管生成、心脏功能及内皮细胞保护等。大量研究表明,植物多糖通过多种机制改善心血管疾病,包括对抗氧化应激、恢复大分子代谢、调节细胞凋亡级联反应,以减少细胞死亡(Dong等,2021)。它们还可以抑制炎症信号通路,以减轻炎症反应。在抗肿瘤活性方面,斑马鱼肿瘤异种移植模型在研究多糖抑制肿瘤血管生成、诱导癌细胞凋亡或抑制肿瘤转移等方面具有独特优势。此外,斑马鱼模型也可用于抗病毒活性研究,评估多糖对病毒复制和宿主免疫反应的影响。
Li等人以斑马鱼为模型,发现通过膳食补充0.01%的黄芪多糖(APS)可以改善生长表现和肠道健康,增强对鲤春病毒血症的抗病毒免疫力(Li等,2021);Wang等人研究了灵芝多糖(GLP)在心血管疾病中的治疗潜力。研究表明,GLP通过多种机制发挥心血管保护作用,特别是在分子水平上通过Nrf2/Keap1通路调节氧化应激,在细胞水平上调节动脉粥样硬化中的巨噬细胞极化,直观展示了GLP在心血管疾病中发挥干预作用的关键机制(Wang等,2025)。
此外,斑马鱼属于硬骨鱼类,与哺乳动物在骨骼结构、骨化机制、骨基质组成等方面存在许多遗传相似性特征。在骨骼健康领域,已有研究探究多糖对骨骼发育、钙磷代谢、骨质疏松症等问题的干预作用;在皮肤健康与抗衰老方面,利用斑马鱼皮肤损伤和抗衰模型,可以来评估多糖的抗氧化和抗炎作用(Li等,2025)。这些多样化的应用进一步突显了斑马鱼模型在功能性多糖研究中的广阔前景。
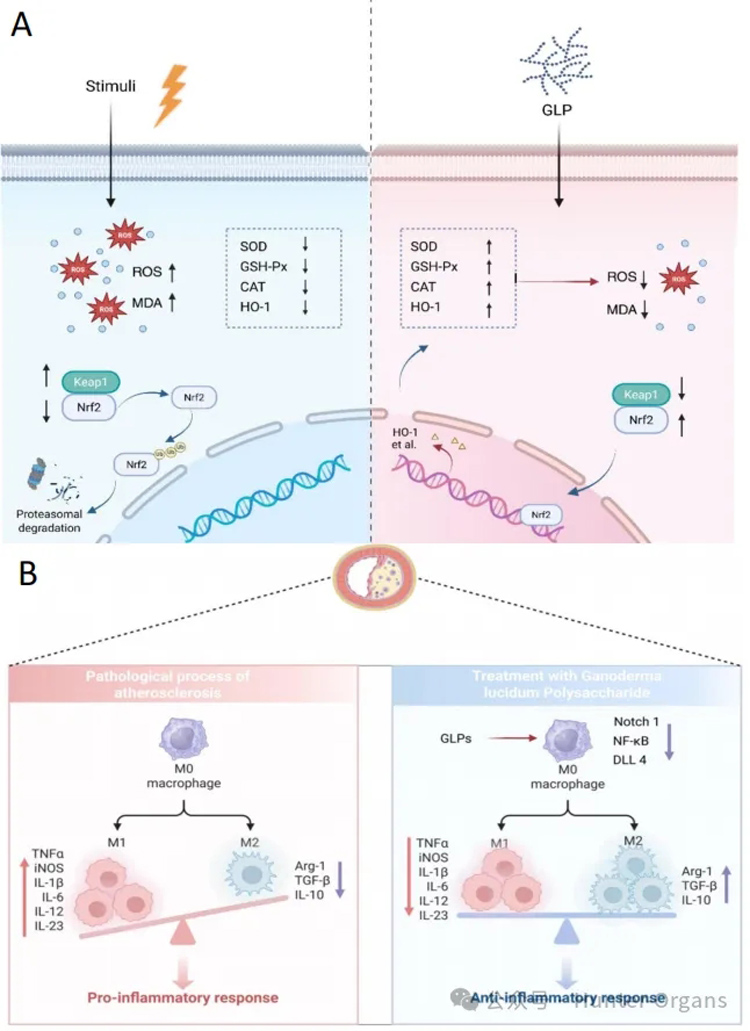
图7
3. 构建五级转化的分层验证体系
为了充分发挥临床应用成功的潜力,需要对斑马鱼筛选结果进行多层次系统验证,通过逐步增强生理相关性,并保持成本效益。这种分层策略有效平衡了斑马鱼的高通量筛选优势与哺乳动物、细胞、类器官、临床实验等的生理相关性,建立了一条从化合物筛选发现到临床应用的可重复、机制驱动的路径。
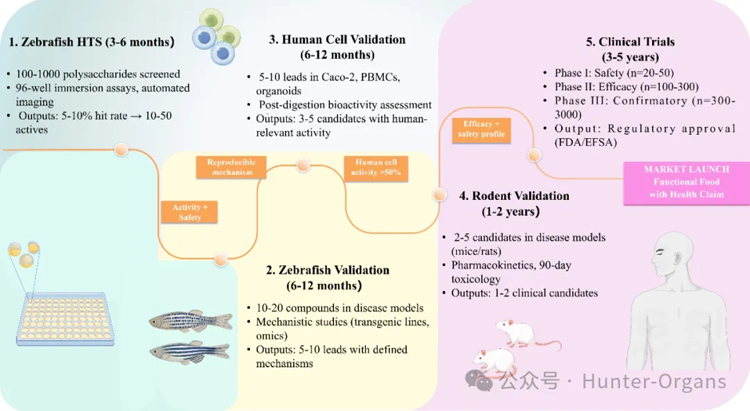
图8
第一层:斑马鱼高通量筛选,快速评估大量候选物:这一综合的五级转化体系始于斑马鱼高通量筛选(HTS),在3-6个月内,通过多孔板浸渍试验快速筛选评价100-1000种多糖,筛选出10-50个活性候选物,其典型命中率为5-10%;
第二层:斑马鱼实验验证,开展疾病模型机制研究:随后,这些候选物将进入斑马鱼验证阶段,持续时间为6-12个月。利用基因编辑及多组学技术,在斑马鱼疾病模型中评估10-20种化合物的作用机制,最终筛选出5-10种具有可重复活性、安全的先导化合物;
第三层:细胞、类器官实验验证相关活性:有潜力的先导化合物随后将进入基于细胞实验的验证阶段,在6-12个月内,在Caco-2单层细胞(人类结肠腺癌)、原代PBMCs(外周血单个核细胞)、肠道类器官等模型中测试5-10个候选物,重点评估在模拟消化过程中的生物活性,并确认人类相关机制。此阶段通常产生3-5种候选物,其在人体中的活性保留率超过50%。
第四层:哺乳动物实验评估化合物疗效、药代动力学和安全性:接着,2-5种候选物将历时1-2年,接受严格的哺乳动物实验验证,开展疾病疗效评估、药代动力学分析及为期90天的毒理学研究,最终,产生1-2种具有可靠生物利用度和安全性的临床候选物。
第五层:经过I期-III期的临床试验,获得监管批准:最后阶段将进行3-5年的临床试验,从I期安全性研究到III期验证性试验,最终获得监管批准并上市一款具有科学证实的、健康的功能性食品。
近年来,环特生物深耕健康美丽产业,开创性地提出“循证功效”研究理念,并自主建立了以细胞、类器官、斑马鱼、哺乳动物、皮肤外植体和人体临床为特色的多维生物技术解决方案。目前,环特已开发了斑马鱼免疫调节、代谢稳态、肠道健康、神经保护与抗肿瘤活性等280多种斑马鱼模型,部分模型如下,欢迎新老客户咨询!
03、编者点评
本综述系统探讨了斑马鱼模型在功能性食品多糖FFPs研究中的应用潜力,概述了建立斑马鱼模型的方法,并全面展示了在免疫调节、代谢紊乱、肠道健康、抗氧化与神经保护作用、抗肿瘤活性等五大研究领域的多场景应用价值,还提出了系统性的验证方案以应对转化瓶颈,概述了精准营养和可持续食品开发的未来方向,将斑马鱼模型确立为功能性食品研发的关键技术,揭示了斑马鱼是加速开发功能性食品多糖类的循证功能食品的一种经济高效的工具。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物基于多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务,欢迎有需要的读者垂询!
参考文献:
Liu, Y., Che, S., Xu, J., & Guo, Y. (2026). Unlocking the potential of functional food polysaccharides: The zebrafish model as a revolutionary high-throughput screening platform. *Carbohydrate Polymers*, *124917*.
